アガロースゲル電気泳動の原理
アガロースゲル電気泳動は、アガロースゲルを用いて核酸(DNA、RNA)をサイズに応じて分離する方法です。アガロースは寒天の主成分である多糖類で、寒天から精製されます。アガロースを沸騰水程度の温度で溶解して冷却すると、網目構造を持つゲルが形成されます。これがアガロースゲルです。アガロースゲルの網目構造は分子ふるいとして機能し、小さな分子は網目構造を容易にすり抜けますが、大きな分子は網目構造に引っかかって通過に時間がかかります。アガロースゲル電気泳動は、アガロースゲルの分子ふるいの性質を利用して核酸を分離します。
核酸はリン酸基を持っており負(-)に帯電しているため、ゲルに核酸を入れて電流を流すとゲル中を正極(+)方向へ移動します。その移動度は主に核酸の大きさ(DNAやRNAの塩基数)とゲル濃度に依存します。基本的には分子ふるいによって短鎖ほど速く、長鎖ほどゆっくり移動するのですが、例えば、アガロース濃度を高くすると網目が細かくなって長鎖は移動しにくくなり、短鎖を精密に分離することができます。逆にゲル濃度を低くすれば短鎖はあまり分離できませんが、長鎖を分けることができます。このように、ゲルの濃度を変えることで、分離できるサイズを調節することが可能です。
アガロース電気泳動を行うには、片側に長方形の細長い穴(ウェル)を開けたアガロースゲルを作製し、バッファーが入った泳動層にゲルを沈め、ローディングバッファーとともに核酸サンプルをゲルのウェルに入れて電流を流します。そうすると、核酸はサイズに応じて分離され、泳動後にゲルを核酸染色液で染色すると、核酸が細長いバンド状に検出されます。この時、サイズが分かっているマーカーを一緒に流して比較することで、バンドのおおよそのサイズを知ることができます。アガロースゲル電気泳動はこの原理を利用して、PCR産物の確認や制限酵素切断の確認など、多様な分子生物学的解析に利用されます。
電気泳動バッファーとアガロース
電気泳動に使用するバッファーは、適切な電流を維持し、pHを安定化させる役割を持ちます。ここでは、DNAの電気泳動に用いられるバッファーとアガロースについて説明します。
DNAの電気泳動には、主にTAEバッファー、TBEバッファーが用いられます。
TAEバッファーの主成分はTris(トリスヒドロキシメチルアミノメタン)、酢酸(Acetate)、エチレンジアミン四酢酸(EDTA)で、TBEバッファーに比べてDNAの移動が速く、高分子の分離が良い傾向があります。ただし、緩衝能がやや弱く、長時間の泳動や高電圧条件ではpHが変化しやすいという欠点があります。
TBEバッファーの主成分はTris、ホウ酸(Borate)、EDTAです。イオン強度が高く、電気伝導性に優れるためDNAの分離能が高く、特に小さな断片の分離に適しています。また緩衝能が強いため、長時間や高電圧での泳動でもpHが安定します。一方で、ホウ酸塩がDNAと弱い相互作用を示すため、ゲルからのDNA回収にはやや不向きです。
適切なゲル濃度と分離可能なDNA断片サイズは、バッファーの種類とアガロースの種類によって異なります。
タカラバイオでは、用途に応じて、さまざまなアガロースを取り扱っております。
例えば、1 kb以上の分離には汎用性の高いアガロースを用い、1%前後の濃度で使用します。
短鎖を精密に分離したい場合は、低分子分離用のアガロースを主に3~4%程度の濃度で用います。また、ゲルからのDNA抽出には純度の高いアガロースが適しています。下記リンク先にタカラバイオで扱っているアガロースの用途、使用濃度、分離能をまとめていますのでご参照ください。
アガロース用途一覧ガイド
アガロースゲルの作製
電気泳動を実施するにはまず、泳動に使用するバッファーを用いてアガロースゲルを作製します。アガロースゲルを作製するにはアガロースをバッファーに溶解して、型(ゲルメーカーセット)に流し込んで固めます。
アガロースの溶解にもコツがあります。
下記のリンクで電子レンジを使ったアガロースの溶解のコツを紹介していますのでご一読ください。
電子レンジを使ったアガロースの溶解:Protocols|タカラバイオ株式会社
タカラバイオでは、Mupidの電気泳動装置とゲルメーカーセットを取り扱っています。
Mupidは長年にわたって多くの研究者に使用されており、日本のアガロースゲル電気泳動のスタンダードと言えます。
Mupid-2plus|タカラバイオ株式会社
Mupid-exU|タカラバイオ株式会社
電気泳動の実際
ゲルを電気泳動槽にセットし、泳動バッファーをゲルが完全に浸る程度に満たします。
チューブ内でDNAサンプルにローディングバッファーを添加します。
ローディングバッファーには比重剤と色素が含まれており、比重剤はDNAサンプルをゲルのウェルに沈め、色素はDNAサンプルを見やすくします。また、色素は電流を流すとDNAと同じ方向に移動し、泳動の進み具合を示す役割もあります。
チューブ内でDNAサンプルにローディングバッファーを添加します。
ローディングバッファーには比重剤と色素が含まれており、比重剤はDNAサンプルをゲルのウェルに沈め、色素はDNAサンプルを見やすくします。また、色素は電流を流すとDNAと同じ方向に移動し、泳動の進み具合を示す役割もあります。
DNA溶液とローディングバッファーの混合液を、ゲルのウェルにアプライします。 電源ボタンを押して泳動を開始します。色素が適切な位置まで流れたら泳動を終了します。
古くからゲル染色にはエチジウムブロマイドが用いられてきましたが、近年は、より高感度で安全性が高い染色液も用いられています。
エチジウムブロマイド
エチジウムブロマイドは二本鎖DNAの鎖の間に入り込んで結合するインターカレーターの一種で、紫外線を照射するとオレンジ色の蛍光を発します。DNAに結合すると蛍光強度が約20倍となり、ゲル中のDNAのバンドを可視化できます。電気泳動後のゲル染色に用いる他、多少移動度は異なりますがゲル作製時にゲルに添加して用いることも可能です。
保存安定性が高く簡便に利用できるため、長年、ゲル染色試薬として利用されてきました。しかしながら、エチジウムブロマイドは変異原性を持つ有害物質であり、取り扱いや廃棄には十分な注意が必要です。
SYBR GREEN(SYBR Green I、SYBR Green II)
SYBR Green Iはインターカレーターの一種で、二本鎖DNAに結合し、紫外線を照射すると緑色の蛍光を発します。二本鎖DNAに結合すると蛍光が著しく増強し、バックグラウンドが低く高感度で検出できることが特長です。エチジウムブロマイドに比べて感度が高く、安全性も高いですが、DNAに結合する性質から変異原性の可能性があるものとして取り扱う必要があります。また、希釈後の安定性は低く(約24時間まで安定)、基本的にはゲル染色時に希釈して用います。
SYBR Green IIは主に一本鎖DNA(ssDNA)やRNAに強く結合する性質を持ち、一本鎖核酸を効率よく検出できる利点があります。
なお、SYBR Green I、SYBR Green IIは二本鎖、一本鎖を特異的に染色するわけではなく、染め分けはできません。
電気泳動は、PCR産物の確認や制限酵素切断後のバンドパターンの確認など、様々な用途に使用することができます。
サイズが分かっている分子量マーカーをサンプルと一緒に泳動することで、サンプルのバンドのサイズを推定することができます。
また、バンドの濃さから大まかなDNA量を推定することができます。
PCR産物の確認では、増幅の有無、増幅産物のサイズ、プライマーダイマーや非特異的増幅の有無などを確認できます。
電気泳動例
3% PrimeGel Agarose PCR-Sieve
1×TAE buffer
DNAの染色
DNA染色液をトレイに入れ、ゲルを浸漬します。古くからゲル染色にはエチジウムブロマイドが用いられてきましたが、近年は、より高感度で安全性が高い染色液も用いられています。
エチジウムブロマイド
エチジウムブロマイドは二本鎖DNAの鎖の間に入り込んで結合するインターカレーターの一種で、紫外線を照射するとオレンジ色の蛍光を発します。DNAに結合すると蛍光強度が約20倍となり、ゲル中のDNAのバンドを可視化できます。電気泳動後のゲル染色に用いる他、多少移動度は異なりますがゲル作製時にゲルに添加して用いることも可能です。
保存安定性が高く簡便に利用できるため、長年、ゲル染色試薬として利用されてきました。しかしながら、エチジウムブロマイドは変異原性を持つ有害物質であり、取り扱いや廃棄には十分な注意が必要です。
SYBR GREEN(SYBR Green I、SYBR Green II)
SYBR Green Iはインターカレーターの一種で、二本鎖DNAに結合し、紫外線を照射すると緑色の蛍光を発します。二本鎖DNAに結合すると蛍光が著しく増強し、バックグラウンドが低く高感度で検出できることが特長です。エチジウムブロマイドに比べて感度が高く、安全性も高いですが、DNAに結合する性質から変異原性の可能性があるものとして取り扱う必要があります。また、希釈後の安定性は低く(約24時間まで安定)、基本的にはゲル染色時に希釈して用います。
SYBR Green IIは主に一本鎖DNA(ssDNA)やRNAに強く結合する性質を持ち、一本鎖核酸を効率よく検出できる利点があります。
なお、SYBR Green I、SYBR Green IIは二本鎖、一本鎖を特異的に染色するわけではなく、染め分けはできません。
結果の判定
染色後のゲルにUVを照射して撮影し、画像を確認します。電気泳動は、PCR産物の確認や制限酵素切断後のバンドパターンの確認など、様々な用途に使用することができます。
サイズが分かっている分子量マーカーをサンプルと一緒に泳動することで、サンプルのバンドのサイズを推定することができます。
また、バンドの濃さから大まかなDNA量を推定することができます。
PCR産物の確認では、増幅の有無、増幅産物のサイズ、プライマーダイマーや非特異的増幅の有無などを確認できます。
電気泳動例
3% PrimeGel Agarose PCR-Sieve
1×TAE buffer
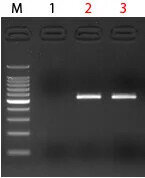
M:100 bp DNA Ladder
1:Negative Control
2:サンプル(542 bp)
3:サンプル(542 bp)
コントロールとしてラダーマーカー等を同時に泳動し、サンプルとマーカーの移動度を比較することでサンプルのサイズを推定することができます。
更に、アガロースゲル電気泳動は、核酸のサイズを判定するのみではなく、目的バンドを含むアガロース片を切り出してDNAを抽出することにより、目的バンドを単離してクローニング等に利用することも可能です。
アガロースゲル電気泳動は、分子生物学の基本的な手法として様々な場面で使用されます。
分子量マーカー
Ladder Markers模式図|タカラバイオ株式会社
Digested Markers 模式図|タカラバイオ株式会社
ローディングバッファー
Loading Buffer|タカラバイオ株式会社
泳動バッファー
TAE (Tris-acetate-EDTA) powder|タカラバイオ株式会社
TBE (Tris-borate-EDTA) powder|タカラバイオ株式会社
核酸染色試薬
SYBR Greenシリーズ|タカラバイオ株式会社
遺伝子工学実験ノート 上 DNA実験の基本をマスターする
羊土社 編/田村 隆明
1:Negative Control
2:サンプル(542 bp)
3:サンプル(542 bp)
まとめ
アガロースゲル電気泳動は、アガロースゲルの網目構造を利用して、DNAなどの核酸を大きさによって分離する方法です。アガロースの種類やゲル濃度を選択することによって、核酸の分離度を調整することができます。コントロールとしてラダーマーカー等を同時に泳動し、サンプルとマーカーの移動度を比較することでサンプルのサイズを推定することができます。
更に、アガロースゲル電気泳動は、核酸のサイズを判定するのみではなく、目的バンドを含むアガロース片を切り出してDNAを抽出することにより、目的バンドを単離してクローニング等に利用することも可能です。
アガロースゲル電気泳動は、分子生物学の基本的な手法として様々な場面で使用されます。
関連製品
タカラバイオでは、アガロース、電気泳動装置の他にもアガロース電気泳動に利用できる製品をご用意しております。分子量マーカー
Ladder Markers模式図|タカラバイオ株式会社
Digested Markers 模式図|タカラバイオ株式会社
ローディングバッファー
Loading Buffer|タカラバイオ株式会社
泳動バッファー
TAE (Tris-acetate-EDTA) powder|タカラバイオ株式会社
TBE (Tris-borate-EDTA) powder|タカラバイオ株式会社
核酸染色試薬
SYBR Greenシリーズ|タカラバイオ株式会社
参考文献
無敵のバイオテクニカルシリーズ遺伝子工学実験ノート 上 DNA実験の基本をマスターする
羊土社 編/田村 隆明
7 件







 sawais
sawais

